光致发光石墨烯材料在细胞成像,显示技术,生物医学和生物传感等领域具有巨大的应用潜力。因此,它们的开发是石墨烯化学一项主要而又极具挑战性的任务。目前为止,基于石墨烯/氧化石墨烯量子点的尺寸限制、氧化石墨烯与光致发光物质的非共价化学结合以及氧化石墨烯能带隙调谐的化学方法已被报道。在这里,我们介绍一种简单的方法,通过一步氟化石墨烯化学法来实现本质上的光致发光石墨烯衍生物,使胺能够控制表面工程/化学还原。具体来说,氟代石墨烯与十二烷基胺和六亚甲基二胺的反应分别产生了亲有机物和亲水性石墨烯衍生物,表现出固有荧光。密度泛函理论计算和实验数据均表明,排放特性的产生是由于胺的选择造成的能量缺口。对NIH/3T3和HeLa细胞的细胞毒性测定表明,亲水胺功能化衍生物具有很高的生物相容性。由于其固有的荧光特性,利用流式细胞仪技术和荧光显微镜成像技术可以直接定量细胞对石墨烯片的吸收和细胞内石墨烯片的定位。这些发现为新型功能光致发光石墨烯衍生物在生物传感、生物医学和生物成像等领域的应用奠定了基础。

Fig. 1. (a, b)具有微米级横向尺寸的CDA和CHMDA纳米片的SEM图像。(c)CDA,(e)CHMDA 和(d)厚度为1.09和1.28 nm的AFM图像。(f) CDA纳米片的TEM图像。(g-j) CDA纳米片的HRTEM-EDX化学作图,碳(蓝色),氟(红色)和氮(绿色)。
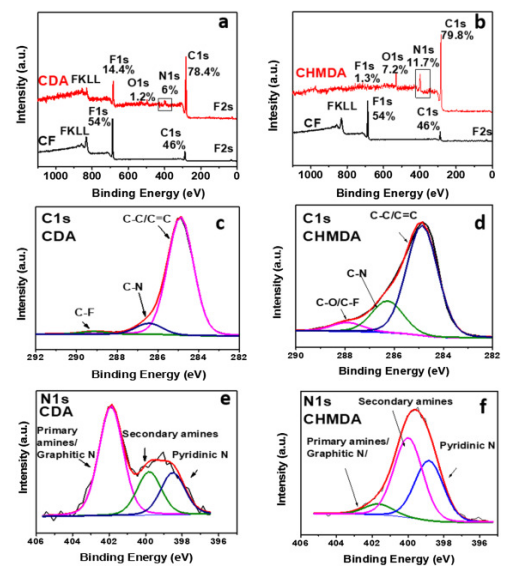
Fig. 2. (a, b)与cf比较CDA和CHMDA的XPS测量光谱。(c, e) CDA的高分辨率C1s和N1s。(d, f) CHMDA的高分辨率C1s和N1s。

Fig. 3. (a)激发波长为350-600 nm的己烷中CDA的光致发光发射光谱。(b)激发波长325-400 nm的CHMDA在水中的光致发光发射光谱。(c, d)在λexc= 375 nm处的CDA和CHMDA光致发光衰减曲线。
 Fig. 4. (a)在自然光下棕色CDA在己烷中的分散(左);在紫外线照射下显示红色光致发光的相同色散(右)。(b)使用绿色(左)或紫色(右)激光束从CDA在己烷中的发射。(c)CHMDA在自然光下的水分散(左);相同的色散在紫外线照射下(约380 nm)产生蓝色/绿色荧光(中间);使用紫激光束从CHMDA在水中发出蓝色/绿色发光(右)。(d-f) CHMDA悬浮液滴在亮场(左)和荧光模式下的光学图像,显示蓝色(中)和绿色(右)发射。
Fig. 4. (a)在自然光下棕色CDA在己烷中的分散(左);在紫外线照射下显示红色光致发光的相同色散(右)。(b)使用绿色(左)或紫色(右)激光束从CDA在己烷中的发射。(c)CHMDA在自然光下的水分散(左);相同的色散在紫外线照射下(约380 nm)产生蓝色/绿色荧光(中间);使用紫激光束从CHMDA在水中发出蓝色/绿色发光(右)。(d-f) CHMDA悬浮液滴在亮场(左)和荧光模式下的光学图像,显示蓝色(中)和绿色(右)发射。
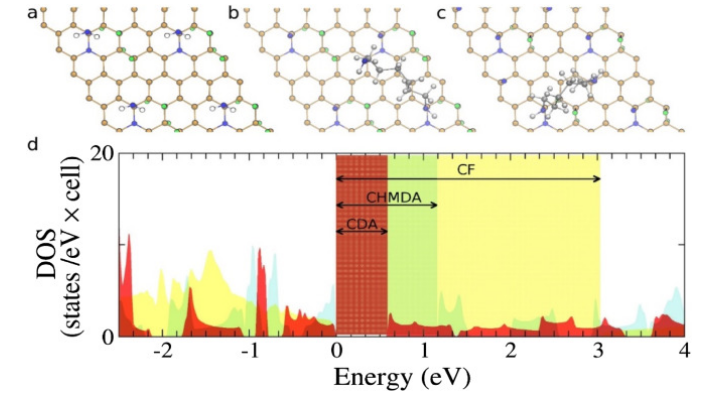
Fig. 5. (a)胺官能化的N掺杂的氟代石墨烯,(b) CDA和(c)CHMDA的最低能量(基态)结构。CDA和CHMDA的DOSs如(d)所示,其中也显示了CF的DOS。

Fig. 6.(a)各种浓度的CHMDA孵育24小时后的细胞活力评估。(b)在HeLa和NIH/3T3细胞中CHMDA孵育24小时后的ROS值。(c)细胞对CHMDA的浓度依赖性摄取。
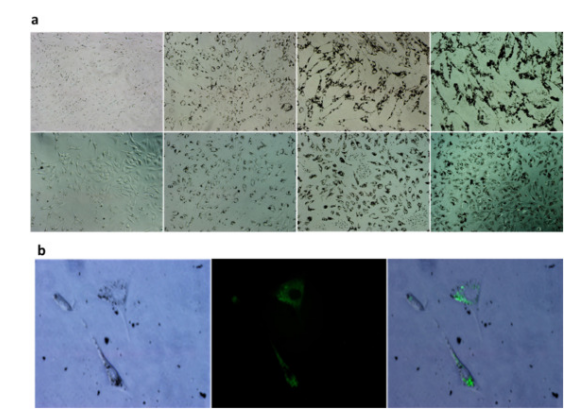
Fig. 7. (a)在10,50,100和150 μg/mL CHMDA(从左至右)孵育24小时后NIH/3T3细胞(上)和Hela细胞(下)的光学图像。(b)用300 μg/ mL CHMDA孵育24小时后NIH/3T3细胞的光学/荧光显微镜检查:(左)具有可见黑色CHMDA簇的明亮细胞区;(中)从胞质溶胶中绿色发射CHMDA;(右)合并左图和中图的图像。

Fig. 8. 在成纤维细胞中CHDMA(左图中的绿色像素)和溶酶体(中间图像中的红色像素)的高度共域化。右图显示了细胞的一个平面层中的绿色和红色通道的3D重建和合并;中央蓝色圆圈是原子核的位置。所有图像均由Leica LAS X软件的一个中心生成。
相关研究成果于2019年由奥洛莫克帕拉克大学Radek Zboril课题组,发表在Applied Materials Today (https://doi.org/10.1016/j.apmt.2019.08.002)上。原文:Intrinsic photoluminescence of amine-functionalized graphene derivatives for bioimaging applications。











