电化学二氧化碳还原为增值化学品或燃料为减少碳排放和缓解能源短缺提供了一种有前途的方法。铜基电催化剂已被广泛报道能够还原二氧化碳以生产各种多碳产品(例如乙烯和乙醇)。在这项工作中,我们开发了硫掺杂的 Cu
2O 电催化剂,它可以通过电化学方式将 CO
2 还原为几乎完全的甲酸盐。我们证明了Cu
2O电解质界面处存在S的动态平衡,并且S掺杂的Cu
2O在CO
2还原反应(CO
2RR)过程中进行原位表面重构,产生活性的S吸附金属Cu位点。密度泛函理论(DFT)计算结合原位红外吸收光谱测量表明,吸附S的金属Cu表面不仅可以促进*OCHO中间体的形成,而且可以大大抑制*H和*COOH的吸附,从而促进CO
2-电化学 CO
2RR 过程中转化为甲酸盐。
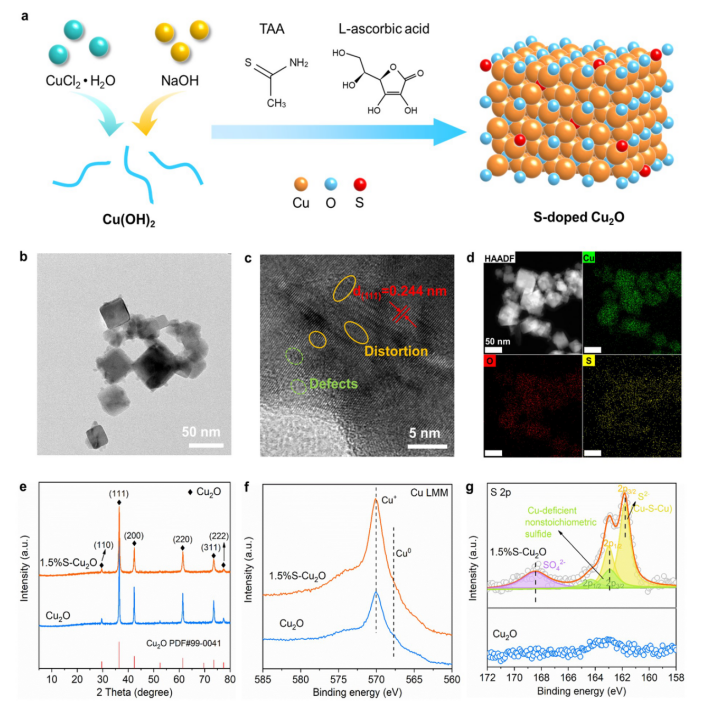
Fig 1. (a) S-Cu
2O 的合成示意图。 1.5%S-Cu
2O 的 (b) TEM 和 (c) HRTEM图像。 (d) 1.5%S-Cu
2O 的 HAADF-STEM 图像和相应的 EDX 元素图。 (e) Cu
2O 和 1.5%S-Cu
2O 的 XRD 图谱。 (f) Cu LMM 光谱,(g) Cu
2O 和 1.5%S-Cu
2O 的高分辨率 S 2p XPS 光谱。

Fig 2. (a) 不同应用电位下的乘积法拉第效率。 (b) 甲酸盐部分电流密度标准化为 Cu
2O 和 1.5%S-Cu
2O 的几何面积。 (c) 具有不同 S 含量的 n%S-Cu
2O 催化剂在 –1.6 V vs. RHE 下的产物部分电流密度。 (d) 在 0.1 M KHCO
3 电解液中,在 –1.2 V vs. RHE 下进行稳定性测试。 (e) 在–1.2 V vs. RHE 下电解后记录的 1.5%S-Cu
2O 的 XRD 图案。 (f) 1.5%S-Cu
2O 在不同反应时间、–1.2 V vs. RHE 下的准原位 Cu LMM 光谱(与电解质接触前后 0 分钟、电解 10 分钟、电解 2 小时。(g) 在–1.2 V vs. RHE 下电解后 1.5%S-Cu
2O 的 S 2p XPS 谱。

Fig 3. (a) Cu
2O/CuxS 催化剂的 S 2p XPS 谱。 (b) 法拉第效率与反应时间的关系。实验在 Cu
2O/CuxS 上进行,每 30 分钟更新一次电解质,相对于 RHE 为 –1.2 V。 (c) CO
2RR 阶段 IV 后 Cu
2O/Cu
2S 催化剂的 S 2p XPS 谱。 (d) 在 0.1 M KHCO
3 + 0.01 mM K
2S 电解液中,相对于 Cu2O,法拉第效率随反应时间在 –1.6 V vs. RHE 的变化。(e) 在含有不同浓度 K
2S(0.01 mM、0.05 mM 和 0.25 mM)的 0.1 M KHCO
3 电解质中,–1.6 V vs. RHE 下相对于 Cu
2O 的法拉第效率。 (f) CO
2RR 后无或有 Ar
+ 溅射 (20 nm) 的 Cu
2O 的 S 2p XPS 光谱。该实验在 0.1 M KHCO
3 + 0.25 mM K
2S 电解质中的 Cu
2O 上进行,电压相对于 RHE 为 – 1.2 V。 (g) 催化剂-电解质界面上硫的动态平衡示意图。

Fig 4. 在 (a, c-d) Cu
2O 和 (b, e-f) 1.5%S-Cu
2O 上的 CO
2 饱和 0.1 M KHCO
3 电解质中,在不同阴极电位下记录的原位 ATR-SEIRAS 光谱。

Fig 5. (a) CO
2RR中间体在S吸附的Cu(111)上的优化结构和最佳吸附构型(橙色:Cu;棕色:C;红色:O;白色:H)。 (b, c) 截面(沿(110)面的二维等高线图)和三维视图(黄色和蓝色区域代表分别为电荷积累和耗尽)。 (d) Cu(111) 和 (e) S 吸附的 Cu(111) 上 CO
2RR 到 CO 和 HCOOH/甲酸盐的自由能图。 *COOH 和 *OCHO 中间体以及配位 Cu/S 原子吸附前(纯点线)和吸附后(实线)的 PDOS:(f) Cu(111) 和 (g) S 吸附的 Cu(111)。
相关研究工作由香港城市大学Bin Liu和北京林业大学Qiang Wang,Tianyu Zhang课题组于2023年联合在线发表在《Angew. Chem. Int. Ed.》期刊上,原文:Sulfur Changes the Electrochemical CO2 Reduction Pathway over Cu Electrocatalyst。
https://doi.org/10.1002/anie.202310740
转自《石墨烯研究》公众号








