空气传播的病原体一旦附着在室内环境中,就会保持长期的感染活性,对公众健康构成普遍威胁。传统的空气过滤器无法有效灭活物理分离的微生物,而化学基抗菌材料则面临稳定性/效率差和病毒灭活效率低的挑战。因此,我们开发了一种快速、可靠的抗菌方法,使用通过直接将单层石墨烯分散在绝缘体上制成的大型隧道电荷驱动消毒装置来对抗室内附着的细菌/病毒。通过隧道效应,自由电荷可以稳定地固定在单层石墨烯下方。储存的电荷可以激发附着微生物的持续电子损失,从而加速消毒,克服化学消毒剂的扩散限制。在放大的设备(25 平方厘米)上附着不到 1 分钟即可实现完全(>99.99%)广谱消毒,在高温(60°C)和湿度(90%)下可靠地持续 72 小时。该方法可以很容易地应用于室内环境中的高接触表面以控制病原体。
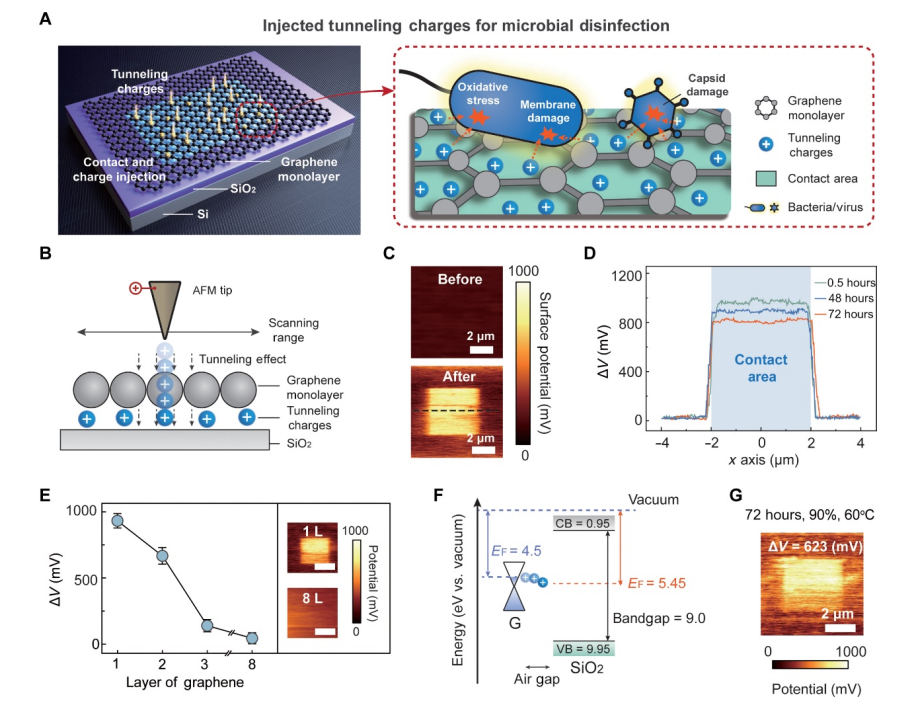
图 1. TCD 方法的概念。(A) 示意图显示基于电荷隧道效应的石墨烯单层电荷注入(左),以及附着在石墨烯表面后通过电子转移使微生物失活的图示(右)。 (B) 当带有偏置电压的 AFM 尖端扫描石墨烯单层时,会发生电子隧道效应。 (C) AFM 尖端扫描之前(顶部)和之后(底部)电荷隧道器件的开尔文探针力显微镜 (KPFM) 图像。 (D) 使用 KPFM 沿 (C) 中的虚线测量的隧道电荷分布。 ΔV 是电荷隧道的电势差。 (E) 石墨烯层数(从 1 到 8)对 ΔV 的影响,表明石墨烯单层实现了电荷隧道。 KPFM 测量中插图的比例尺为 2 μm。 (F) 石墨烯和SiO2 的界面能量排列图。 (G) 电荷隧道器件在恶劣环境(90% 湿度和 60°C 温度)下 72 小时的 KPFM 图像。在(C)至(E)中,实验在固定温度(20℃)和湿度(30%)下进行。误差线代表 SD (n = 3)。
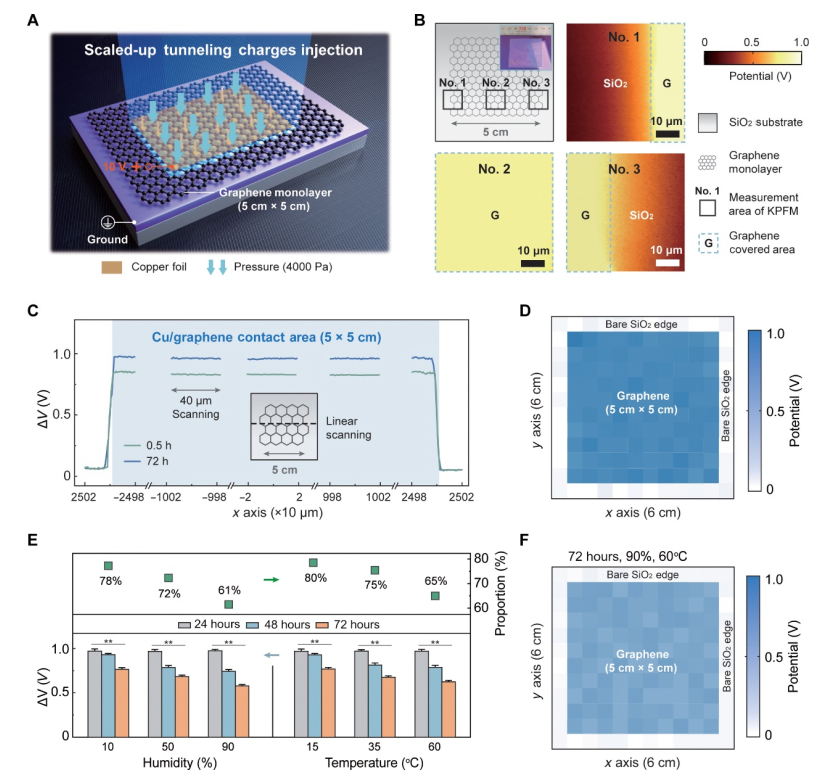
图 2. 大规模电荷隧道,实现均匀稳定的电荷保留。
(A) 电荷隧道器件放大方法的示意图。该器件由覆盖 SiO2 表面的石墨烯单层 (5 cm × 5 cm) 组成;通过向铜箔施加偏置电压 (10 V) 和外部压力 (4000 Pa) 来实现电荷注入。 (B) 大型电荷隧道器件不同位置(边缘和中心)的 KPFM 测量。插图显示了大型设备。 (C) 注入隧道电荷沿插图中虚线的 ΔV 分布。 (D) 铜箔充电后器件表面上的 ΔV 分布分为 12 × 12 个区域(每个区域为 5 mm × 5 mm)(蓝色区域)。 (E) 72 小时后湿度(高达 90%)和温度(高达 60°C)对大型器件注入隧道电荷的影响。 (F) 在恶劣环境(90%湿度和60°C温度)下储存72小时后,器件表面上的ΔV分布分为12×12个区域。在(B)至(D)中,实验在固定温度(20℃)和湿度(30%)下进行。误差线代表 SD (n = 3)。组间显着差异分别用 * 和 ** 表示,P < 0.05 和 P < 0.01。
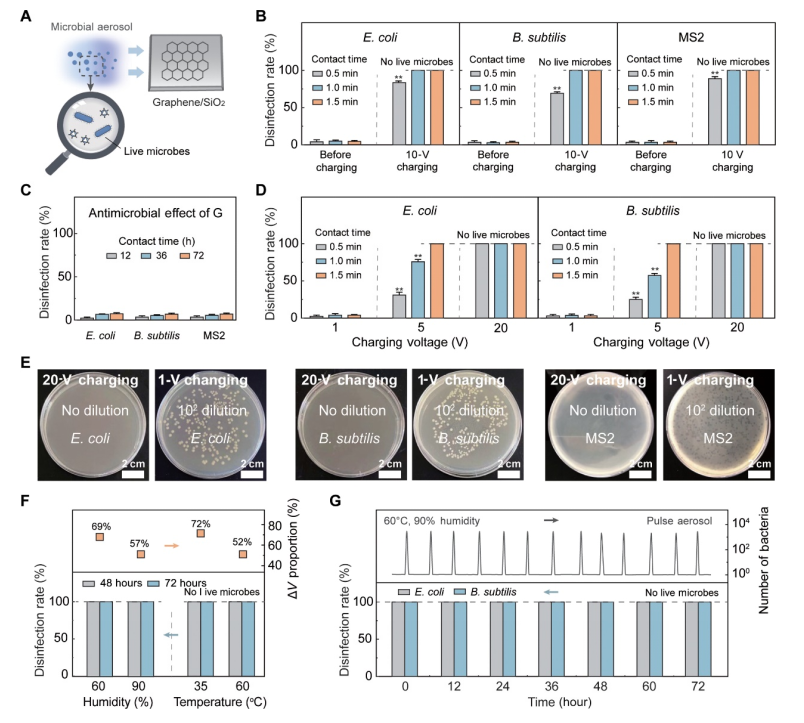
图 3. 放大的 TCD 装置对微生物灭活的功效。
(A) 使用放大的 TCD 装置的微生物灭活过程示意图,其中含有细菌或病毒的气溶胶在电荷注入后分散在装置表面。 (B) 不同模型微生物的微生物灭活效率 [E.大肠杆菌(革兰氏阴性细菌)、枯草芽孢杆菌(革兰氏阳性细菌)和 MS2 噬菌体(病毒)]。 (C) 石墨烯对微生物灭活效率的影响。设备上未施加充电电压。 (D) 充电电压对微生物灭活效率的影响。 (E) 显示使用放大的 TCD 设备在 20 和 1 V 充电电压下大肠杆菌(左)、枯草芽孢杆菌(中)和 MS2(右)浓度的图像。 (F) 48 小时和 72 小时后湿度(高达 90%)和温度(高达 60°C)对 TCD 装置灭活大肠杆菌功效的影响。 (G) 在处理间歇性施用的含有大肠杆菌或枯草芽孢杆菌的气溶胶时,TCD 装置对细菌灭活的功效。在(B)至(E)中,实验在固定温度(20℃)和湿度(30%)下进行。在(E)至(G)中,将TCD装置充电至10V,并在附着1分钟后测量微生物。虚线表示所有微生物均已灭活(即未检测到活微生物)。误差线代表 SD (n = 3)。组间显着差异分别用 * 和 ** 表示,P < 0.05 和 P < 0.01。
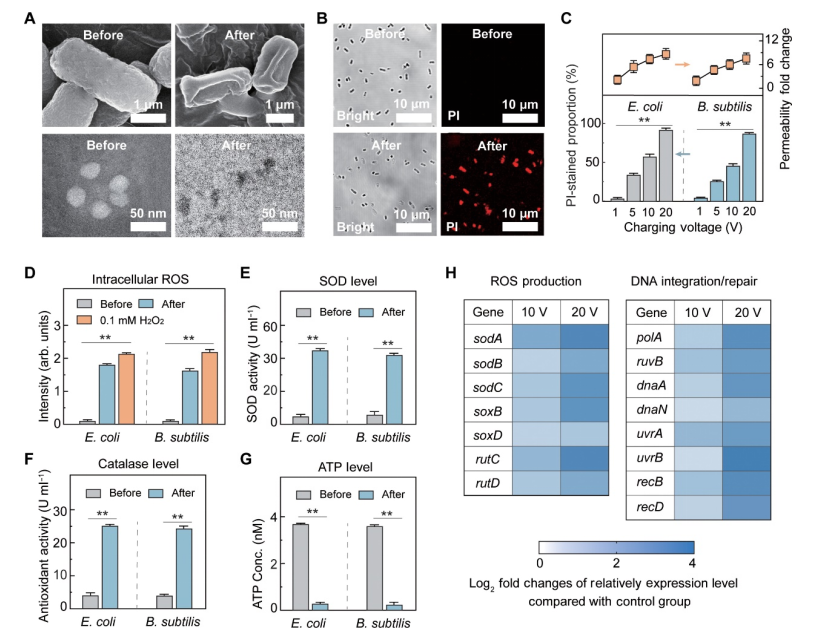
图4. TCD装置抗菌机制研究。
(A) 附着到 TCD 之前和之后的细菌(大肠杆菌;顶部)的 SEM 图像和病毒(MS2;底部)的 TEM 图像。 (B) 荧光显微镜显示大肠杆菌在附着到 TCD 之前(顶部)和之后(底部)的明场(细菌总数)和荧光(膜受损细菌)图像。 (C) 在不同充电电压(1 至 20 V)下附着到 TCD 后,大肠杆菌和枯草芽孢杆菌(上图)膜通透性的变化以及膜结构受损的细菌百分比(下图)。 (D) 附着于 TCD 后细胞内产生 ROS。 (E) 细菌超氧化物歧化酶的活性。 (F) 细菌抗氧化酶的活性。 (G) TCD 处理的细菌中细胞内 5'-三磷酸腺苷 (ATP) 水平。 (H) 与 ROS 产生和 DNA 整合/修复相关的关键基因的表达。附着1分钟后评估微生物。在(A)、(B)和(D)至(H)中,TCD装置充电至10V。实验在固定温度(20℃)和湿度(30%)下进行。误差线代表 SD (n = 3)。组间显着差异分别用 * 和 ** 表示,P < 0.05 和 P < 0.01。
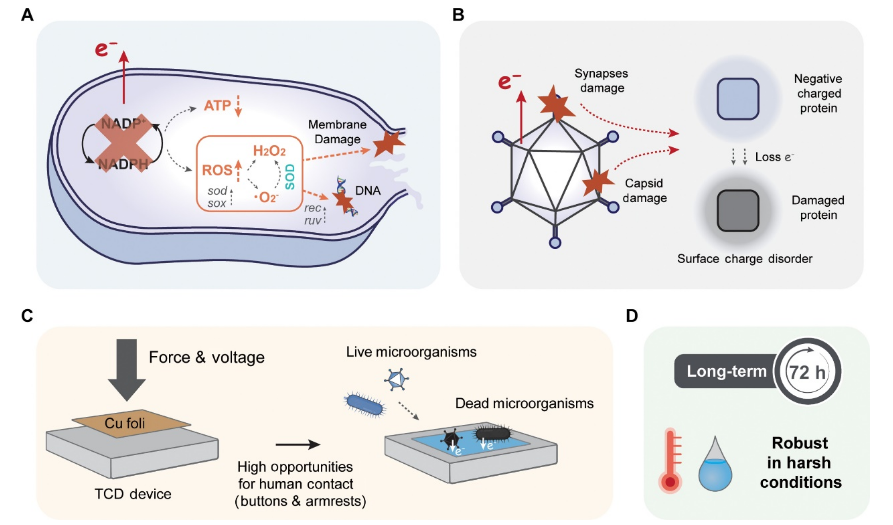
图5. TCD装置的抗菌机制及其潜在应用。
(A 和 B) 基于电子转移的 TCD 过程中涉及的细菌 (A) 和病毒 (B) 灭活机制的示意图。 (C) TCD 设备在室内环境中高接触表面(例如电梯按钮和医院扶手)的潜在应用场景。 (D) TCD 装置在实际应用中用于微生物灭活的独特性能(可靠性和稳健性)。
相关科研成果由延世大学Sang-Woo Kim等人于2024年发表在Science Advances(https://doi.org/10.1126/sciadv.adl5067)上。原文:Highly efficient microbial inactivation enabled by tunneling charges injected through two-dimensional electronics
原文链接:https://doi.org/10.1126/sciadv.adl5067
转自《石墨烯研究》公众号








